门捷列夫发现元素周期表的故事概括
一提到元素周期表,我相信大家现在依然能口述出前二十位元素,因为元素周期表在我们的学习生涯中,和乘法口诀的重要性相当。
所以我们今天就聊一聊元素周期表是如何发展的,以及在解释元素化学性质的趋势方面,原子结构被人们理解之前的作用和预测未知元素方面的重要性。
118号Uuo重元素的发现
谈现代炼金术和“超重”元素的发现:自从门捷列夫提出元素的周期性分类理论以来,科学家们就开始着手发现了更多的元素。
过去40年左右的时间里,科学家们用高能粒子轰击原子一直在寻找地球上通常不存在的元素。试图实现炼金术士点石成金的梦想,即把一种元素变成另一种元素。
1999年,加州的科学家声称已经制造出了118号“超重元素”。
他们从元素周期表的位置预测,这种元素将是第七种惰性气体。三年后,这些科学家撤回了他们的发现,原因是他们无法通过重复实验来发现这种新元素。
但是在2002年至2005年期间,俄罗斯和美国科学家通力合作最终收集到足够的证据,并宣布发现了118号元素。
科学家们的结果表明,他们从这种新元素中制造了几个原子,然后这些原子自发地分解成更简单的元素。
该元素的符号为Uuo,名称为ununoctium。
这种元素的符号和名称看起来并不像我们平时认识到的其他元素,科学家们可能需要很多年才能给它一个两个字母的原子符号和一个合适的名称,因为在定义元素名称上必须有国际协议。

德米特里·门捷列夫及其元素的性质
几千年来,人们对周围世界的物质性质一直很好奇,并对构成这些物质的最简单的物质形式或“元素”进行了理论研究。
然而,直到近200年现代实验工作开始以来,化学家们才确信他们已经发现了元素,一种化学上无法转化为更简单物质的物质。
这时化学家才能开始设计出有用的理论来解释元素是如何相互联系的,这些理论有助于科学家在材料学的知识和理解上取得进展。
1869年2月17日,俄国化学家德米特里·门捷列夫(Dmitri Mendeleev)发表了关于元素性质的著作,他把早期人们的观察和发现,按照原子质量的顺序把化学元素的符号集合起来。
门捷列夫的对化学元素的整合成为第一个现代元素周期表。极大地加速了新元素的发现和对其性质的理解。
关于元素的早期想法
2000多年前,古希腊人把世界上所有的物质都描绘成由土、水、空气和火四种“元素”组成的。
现在让我们看来,这个想法似乎很不靠谱,但古希腊人是思想家,而不是实验科学家。他们的模型反映了物质的三种状态。如固体、液体、气体,它们具有相互转化的能力。
一些比古希腊文明还要久远的文明,它们通过将矿石与木炭混合,在一个简单的熔炉中加热,就能生产出铜和汞等金属元素。
在古代生产金属及其合金的动力不是因为人们对化学本身感兴趣,而是因为人们需要制造耐磨性强、不易破碎的工具和武器。
早期的阿拉伯文明以其对化学的实际兴趣而闻名,并为我们提供了目前化学中常使用的词汇,如炼金术和碱。
特别是在中世纪,欧洲的炼金术士们努力寻找从铅和其他金属中提炼黄金的方法,他们并不知道这在化学上是完全不可能的。
道尔顿原子理论
在道尔顿的原子理论中,他提出了原子是一种元素中最小的部分,并且不能被分裂,而且一种特定元素的原子有其特有的质量。
我们现在称这个质量为元素的相对原子质量,但在道尔顿时代,它被称为原子量。
整个19世纪初,化学家们通过改进他们的技术继续寻找着新元素,但由于缺乏预测未知元素存在的基础,所以他们的工作犹如大海捞针,缺乏系统性。
德贝赖纳和他的三素组定律
约翰·德贝赖纳(Johann Dobereiner)是寻找元素分类方法的科学家之一。1829年,他报告了他在当时已知的元素中发现的模式和规律。
他注意到,具有类似性质的元素可以分为三个元素,即三素元素,并且在它们的相对原子质量值中有一个数学模式。其中一个三素组合是锂、钠和钾,这些元素是戴维通过电解发现的。
纽兰八度
德贝赖纳的发现已经开始给大自然带来了秩序。他的研究显示出相对原子质量中存在的模式。
1864年,约翰·纽兰兹将元素按相对原子质量的顺序排列。他也发现了一种模式,具有相似化学性质的元素彼此之间相隔八个位置,就像八度音阶中的音符一样。
看下表,如果你以锂为“1”开始,数八种元素,你就会得到钠。这两种元素在物理和化学上非常相似。再加上八种元素,你就会得到钾,这与锂和钠非常相似。

虽然八度法则适用于某些元素,但也有例外。看看硫和铁,它们又是分开的八种元素,但它们的性质却截然不同。
它需要另一个分组系统来理解这些差异,但纽兰过于专注于八度音阶的概念,思维受到了限制,所以没有进一步做出解释。
门捷列夫与周期表的发展
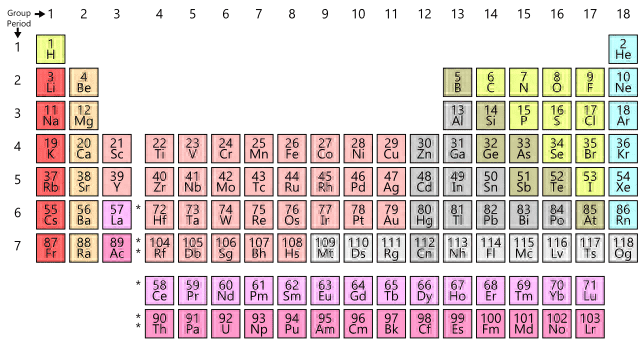
俄国化学家门捷列夫被这些元素深深的迷住了。他把每个已知的元素及其属性写在一张单独的卡片上,并开始按逻辑顺序进行排列,如下表所示。
但他首先忽略了氢,因为门捷列夫觉得它似乎不适合任何位置,而是选择从锂开始。在原子量的指导下,他把铍、硼、碳、氮、氧和氟放在一个竖列里。
下一个元素是钠。他把钠放在锂旁边,因为锂和钠都是活性软金属。然后镁、铝、硅、磷、硫和氯等元素也相应地找到了它们的位置。
门捷列夫继续研究钾和钙。下一位置应该出现什么元素?钛似乎低于钙。
然后门捷列夫做出了一个明智的决定。他认识到,钙和钛之间必须留有一个缺口,才能找到一种尚未被发现的元素。
因为钛的化学性质更像碳和硅,而不是硼和铝,所以门捷列夫把钛放在硅旁边。
门捷列夫总结道:“元素,如果按照它们的原子量(现在称为相对原子质量)来排列,会表现出明显的周期性。”

注意,门捷列夫首先将元素放在列中。不久之后,他决定对我们熟悉的元素周期表进行排列。
每个元素在表格中都有自己的编号和固定的位置,门捷列夫为当时未知但他相信存在的元素留下了一些空白。

门捷列夫早期的元素周期表在他那个时代的化学家中产生了相当大的影响,因为元素周期表揭示了已知和未知元素特性的清晰模式和趋势。
化学家们第一次能够猜测可能存在的元素,周期表上的缺口也激励着化学家们有目标的去寻找新的元素。
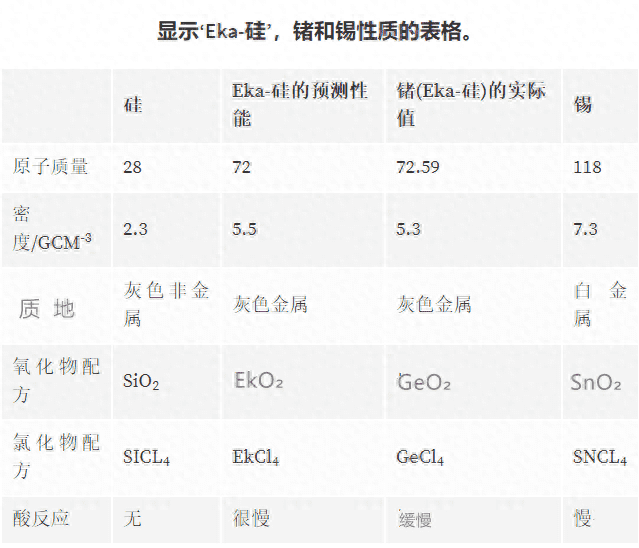
门捷列夫利用他的表格预测了元素钪、镓以及锗的性质,他首先将锗命名为“EKA-硅”。在随后的20年内,这三种元素都被发现。
下表显示了他预测锗的性质,以及后来发现的锗的实际性质。
总的来说,门捷列夫预测了10种未知元素的性质,后来证明8种元素是正确的。
门捷列夫是根据元素的性质来定位元素的。当元素的原子量(相对原子质量)不符合它们的原子量顺序时,他假定这些元素原子量的测定是不正确的。
例如,他把钴放在镍之前,但钴的质量更大。
我们已经看到,根据元素的性质,元素周期表中的一些元素必须按照它们相对原子质量的顺序排列。
我们现在知道相对原子质量取决于原子核的整体结构,而元素原子序数的顺序决定了它们性质的变化趋势。
元素的原子序数是在该元素的一个原子中发现的质子数。
